MADRID, 8 Mar. (EUROPA PRESS) -
Aunque la mayoría de las personas sobreviven a ataques cardíacos, el tejido cardíaco suele sufrir daños irreparables. A diferencia de muchas otras células del cuerpo, una vez que están lesionadas, las células cardíacas no pueden regenerarse. Según un estudio de la Universidad de California en San Francisco (Estados Unidos), el problema puede remontarse a los primeros antepasados mamíferos: perdieron la capacidad de regenerar el tejido cardíaco a cambio de endotermia, o como se conoce coloquialmente, la 'sangre caliente'.
Los primeros mamíferos eran pequeñas criaturas parecidas a roedores que emergían en un mundo dominado por animales de sangre fría. En lugar de competir directamente, desarrollaron una estrategia novedosa que les permitió ocupar nuevos nichos: la endotermia. Mientras que los animales de sangre fría, incapaces de regular su propia temperatura corporal, fueron rehenes de condiciones climáticas siempre cambiantes y relegados a climas templados, los mamíferos de sangre caliente pudieron propagarse por climas más fríos y prosperar de forma nocturna.
Pero, como muestra el nuevo estudio, esto tuvo un coste elevado. Este avance evolutivo marcó el comienzo de la era de los mamíferos, pero dejó a los humanos modernos vulnerables a daños irreparables en los tejidos después de un ataque al corazón. "Muchos de los vertebrados pueden regenerar partes y órganos del cuerpo, incluido el corazón, pero la mayoría de los mamíferos no pueden. Esta característica se perdió en algún lugar de la transición de ectoterma a endoterma",explica el autor principal del estudio, Guo Huang.
A primera vista, no hay una conexión obvia entre la capacidad de un mamífero para regular su temperatura corporal y su incapacidad para reparar el daño cardíaco. Pero el nuevo estudio, publicado en la revista 'Science', revela que estos rasgos biológicos aparentemente dispares están inextricablemente unidos por las hormonas tiroideas.
La glándula tiroides produce un par de hormonas bien estudiadas que se sabe que regulan la temperatura corporal, la tasa metabólica y la función normal del corazón. Debido a su papel crítico en la promoción de la generación de calor para mantener la temperatura corporal, estas hormonas se han considerado como la fuerza impulsora detrás de la transición evolutiva de la sangre fría a la sangre caliente.
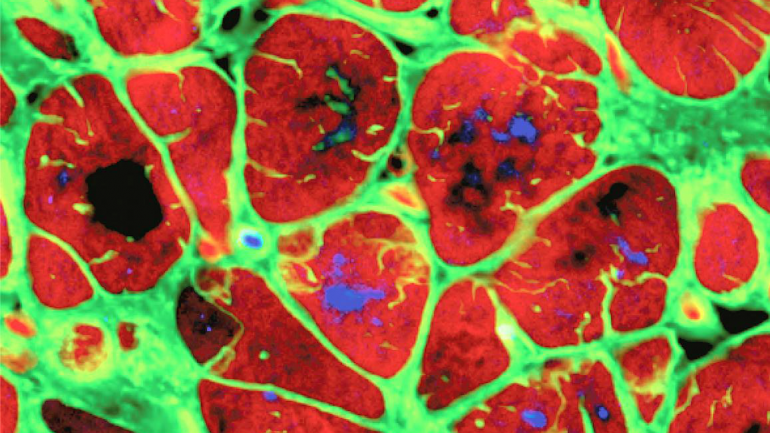
Pero el estudio de Huang reveló que estas hormonas también son responsables de apagar la división de las células cardíacas, lo que evita que el tejido cardíaco se repare a sí mismo después de una lesión. Este descubrimiento representa la primera conexión demostrada entre las hormonas tiroideas, el desarrollo y la reparación cardíacos y la evolución de la endotermia.
El equipo de Huang adoptó un enfoque multiespecífico, comparando la ploidía de las células cardíacas (el número de copias de cada par de cromosomas en una célula) en 41 especies diferentes de vertebrados. La ploidía está estrechamente vinculada a la capacidad de una célula para dividirse y replicarse. Prácticamente todas las células animales que se dividen activamente son diploides, que contienen solo un par de cada cromosoma, una copia heredada de las madres y otra de los padres. Por el contrario, las células poliploides contienen copias múltiples de cada par y generalmente no pueden dividirse.
Este enfoque comparativo reveló una clara conexión entre la ploidía y la temperatura corporal. Los animales de sangre fría (peces, anfibios y reptiles) tenían células del corazón que eran en gran medida diploides y respondían a las lesiones cardíacas aumentando la división celular. Los mamíferos de sangre caliente tenían células del corazón que eran abrumadoramente poliploides, y los experimentos de laboratorio confirmaron que estas células rara vez se dividen en respuesta al daño cardíaco.
"Esto nos llevó a la hipótesis de que las mismas hormonas tiroideas responsables de regular la temperatura corporal también podrían ser responsables de la transición de diploides a poliploides y la detención de la división de las células cardíacas", comenta Huang.
EN RATONES (SANGRE CALIENTE)
Los investigadores confirmaron su 'corazonada' en una serie de experimentos de laboratorio con ratones, un mamífero de sangre caliente en el que las células del corazón normalmente no pueden regenerarse, y el pez cebra, un animal de sangre fría que se destaca por su capacidad para reparar completamente su corazón, incluso si se amputa quirúrgicamente hasta el 20 por ciento de su tamaño.
En el útero, los ratones tienen células cardíacas diploides que se replican regularmente para producir nuevo tejido cardíaco. Pero las células cardíacas de los ratones recién nacidos se someten a una poliploidización rápida y pierden la capacidad de dividirse. Esto coincide con un aumento de más de 50 veces en las hormonas tiroideas circulantes.
Los experimentos mostraron que estos eventos fueron más que una mera coincidencia. Cuando los investigadores inyectaron ratones recién nacidos con un medicamento que bloqueaba los receptores de la hormona tiroidea e inspeccionaron sus corazones dos semanas después, encontraron cuatro veces más células de músculo diploide del corazón en división que los ratones que no recibieron ningún medicamento. Se observaron resultados similares cuando administraron un medicamento diferente que impedía la producción de hormonas tiroideas.
Los investigadores también produjeron ratones genéticamente modificados cuyas células cardíacas carecían de un receptor funcional para la hormona tiroidea, lo que permitió que sus corazones se desarrollaran libres de la influencia de las hormonas tiroideas. A diferencia de los ratones normales, se encontró que estos ratones mutantes tenían un número significativo de células del corazón diploides en división activa.
Además, cuando restringieron el flujo de sangre al corazón, observaron un aumento de 10 veces en el número de células cardíacas en división y un 62 por ciento menos de tejido cicatricial en comparación con los ratones normales. Mientras tanto, los ecocardiogramas revelaron una mejora del 11 por ciento en la función cardíaca en comparación con los ratones normales después de la lesión.

EN PECES CEBRA (SANGRE FRÍA)
En marcado contraste con los ratones y otros mamíferos, el pez cebra adulto tiene niveles relativamente bajos de hormona tiroidea circulante. Esto llevó a Huang a preguntarse si el aumento de los niveles de hormona tiroidea podría apagar la maquinaria de autoreparación que hace que los corazones de pez cebra sean excepcionalmente resistentes.
Los investigadores agregaron hormona tiroidea al agua en tanques de pez cebra, luego amputaron quirúrgicamente una porción del corazón y proporcionaron a los peces un amplio tiempo de recuperación. Normalmente, el pez cebra podría reparar completamente este tipo de daño en el transcurso de unas pocas semanas.
Pero los peces que se criaron en un ambiente de alta hormona experimentaron una reducción del 45 por ciento en la división de las células del corazón, un aumento significativo en las células del corazón poliploides y una marcada cicatrización del tejido del corazón después de la lesión. Al igual que en los mamíferos, las hormonas tiroideas condujeron a una regeneración cardíaca dañada en los peces.
"Nuestros resultados demuestran una función conservada evolutivamente para la hormona tiroidea en la regulación de la proliferación de las células del corazón y sugieren que la pérdida del potencial regenerativo fue una compensación que permitió a los mamíferos convertirse en de sangre caliente. Para los primeros mamíferos, la endotermia era más ventajosa que la retención del potencial regenerativo. Pero ahora, con las mejoras médicas que nos permiten vivir mucho más tiempo, esta pérdida de regeneración cardíaca se vuelve más problemática y es una causa fundamental de enfermedades", concluye el investigador.